Cómo pequeñas partículas de oro inyectadas en los tumores podrían mejorar el tratamiento con radiación para el cáncer
Un revolucionario tratamiento promete terminar con las consecuencias secundarias de la radioterapia.
El cáncer es la segunda causa principal de muerte a nivel mundial. En 2018, hubo 18,1 millones de casos nuevos y 9,5 millones de muertes relacionadas con el cáncer en todo el mundo. Para 2040, se espera que el número de nuevos casos de cáncer por año aumente a 29,5 millones y el número de muertes relacionadas con el cáncer a 16,4 millones.
Aproximadamente el 50 por ciento de todos los pacientes con cáncer pueden beneficiarse de la radioterapia en el tratamiento de su enfermedad. Aproximadamente la mitad de esos pacientes reciben un diagnóstico lo suficientemente temprano como para que su cáncer sea curable. Para muchos cánceres, incluidos los de mama, próstata, cuello uterino, cabeza y cuello, pulmón y cerebro, el tratamiento curativo incluye radioterapia. Sin embargo, debido a que la radioterapia destruye tanto las células sanas como las células tumorales, las dosis son limitadas.
La radioterapia se usa sola para tratar el cáncer o con otras opciones de tratamiento como quimioterapia y cirugía. También se puede usar para encoger el tumor antes de la cirugía. En la radioterapia, las células tumorales, que se dividen mucho más rápido que otras células sanas circundantes, se destruyen al dañar su ADN.

El factor limitante en la radioterapia es que las dosis lo suficientemente altas para tratar de curar los tumores no metastásicos de alto riesgo (localmente avanzados) también dañan los tejidos normales circundantes. Actualmente, estamos en el límite de la dosis de radioterapia que se puede administrar a los pacientes. Para mejorar aún más la supervivencia, se necesitan nuevos métodos que mejoren la eficacia de la radiación y reduzcan los efectos secundarios.
Una forma de lograr esto es hacer que las células tumorales sean más sensibles a la radiación, de modo que esas células se dañen más fácilmente con la radioterapia. El uso de nanopartículas de oro como radiosensibilizadores ha mostrado resultados prometedores. Estas nanopartículas de oro se pueden introducir por vía intravenosa para acumularse en el tumor al explotar las paredes defectuosas de los vasos sanguíneos del tumor, que tienden a tener fugas debido al rápido crecimiento.
Las nanopartículas de oro interactúan con los fotones de rayos X utilizados en el tratamiento de radiación que produce electrones, que luego interactúan con las moléculas de agua para producir radicales libres. Estos radicales libres pueden dañar las células, reduciendo la supervivencia de esas células.
Comprender el complejo sistema biológico presente en y alrededor del tumor es esencial para optimizar el uso de los GNP radiosensibilizantes, como lo describe un consorcio de laboratorios, incluido nuestro propio laboratorio de desarrollo de nanociencia y tecnología en la Universidad de Victoria.
En este trabajo, discutimos la importancia de investigar qué componentes celulares dentro del microambiente del tumor absorben las nanopartículas de oro y se radiosensibilizan. Estamos particularmente interesados en las células llamadas fibroblastos activados, que están asociados con la cicatrización de heridas y tienen propiedades antitumogénicas, lo que significa que ayudan a combatir el crecimiento tumoral.
Sin embargo, los fibroblastos activados pueden ser reclutados por las células tumorales y convertirse en fibroblastos asociados al cáncer (CAF). En lugar de propiedades anti-tumorigénicas, los CAF promueven la proliferación y metástasis de tumores.
La función de los CAF respalda la idea de que los tumores son “heridas que no cicatrizan” y que dirigirse a los CAF puede resultar beneficioso para mejorar los resultados del tratamiento del cáncer.
Nuestra investigación sobre la incorporación de nanopartículas de oro en los protocolos de tratamiento de radiación actuales tenía tres objetivos: mejorar la destrucción de las células tumorales, apuntar a los CAF y proteger los fibroblastos.
Para que la radiosensibilización sea eficaz en la mejora del tratamiento con radiación, las células objetivo del tratamiento (las asociadas con el crecimiento del cáncer) deben tener una alta absorción de las partículas radiosensibilizantes, mientras que las células beneficiosas deben tener una baja absorción. Esto hace que las células diana se destruyan más fácilmente mediante la radioterapia en dosis que los pacientes pueden tolerar.
Estos resultados utilizando tumores 3D cultivados en el laboratorio son muy alentadores. Los CAF tuvieron la mayor absorción de nanopartículas de oro por célula, con casi el triple de las células cancerosas, mientras que los fibroblastos tuvieron un número relativamente pequeño. Esto también se tradujo en un mayor aumento del daño del ADN en las CAF en comparación con los otros tipos de células, lo que redujo la actividad de las CAF y ralentizó el crecimiento tumoral.
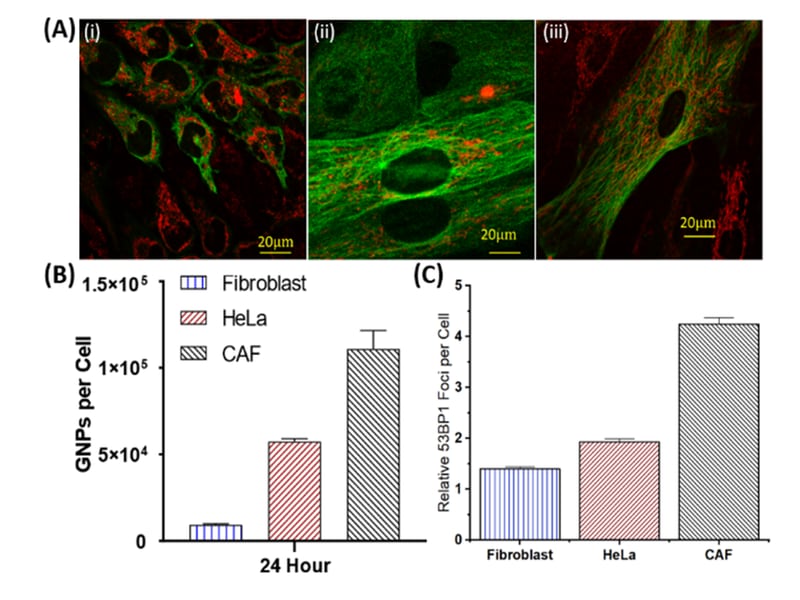
Esta diferencia en el daño del ADN debido a la orientación selectiva de las células asociadas al cáncer sobre las células normales puede permitir que las nanopartículas de oro sean una herramienta eficaz en la radioterapia contra el cáncer en el futuro, ayudando a minimizar el daño al tejido normal y mejorando la dosis de radioterapia local al tumor.
Este estudio muestra que el uso de nanopartículas de oro como radiosensibilizador permite que se propague más daño a los CAF, un elemento que ha demostrado tener una gran influencia en la progresión del cáncer. Creemos que este trabajo será un elemento fundamental hacia un régimen de tratamiento más eficaz en un futuro próximo. La construcción de un modelo que pueda representar con precisión las diferentes interacciones que tienen lugar dentro del microambiente del tumor es esencial para mejorar los resultados del tratamiento para los pacientes.
* Profesora asociada de Física y Astronomía y Física médica, Universidad de Victoria

Comenta
Por favor, inicia sesión en La Tercera para acceder a los comentarios.