La advertencia del ISP: test rápidos no sirven para diagnosticar Covid y su venta es “irresponsable”
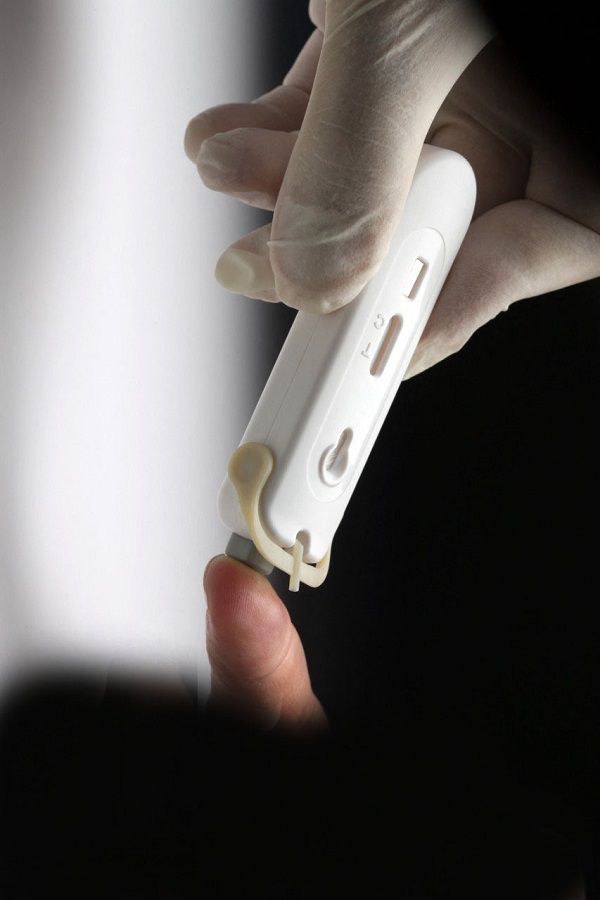
Organismo investigó y sostuvo una reunión con los importadores de estos dispositivos y advierte que su venta en redes sociales es irresponsable y que solo se debieran utilizar bajo la supervisión de personal de salud.
Se ofrecen en grupos de WhatsApp, redes sociales, avisos comerciales, farmacias. Los precios son muy variables, con opciones “familiares” para aplicar a cinco personas, 50 o más de 100. Son los mal llamados test de detección rápida de Covid-19, una prueba que se vende como detección inmediata del virus, pero que en realidad no lo es.
Hoy el Instituto de Salud Pública (ISP), no solo publicó el listado de este tipo de test que han sido autorizados por otras agencias reguladoras alrededor del mundo, sino que aclaró específicamente que no sirven para el diagnóstico de la enfermedad, que no son autotest para aplicar en casa y que debe ser manipulado por el personal de salud.
Heriberto García Escorza, director (s) Instituto de Salud Pública de Chile (ISP), señala que estos kits de anticuerpos o test rápidos detectan la respuesta inmune del organismo, a la infección causada por el virus, pero no detectan el virus en sí. “En los primeros días de una infección, cuando la respuesta inmune aún se está desarrollando, es posible que no se detecten anticuerpos contra Covid-19. En razón de esto, se debe tener especial cuidado con su interpretación, teniendo en cuenta la fase de infección”.
¿En qué se pueden utilizar? Según García, pueden ser útil en investigaciones epidemiológicas o estudios de brotes, siempre que sean estudios de control, con población objetiva y con profesionales clínicos a cargo.
Respecto de los test que se ofrecen en redes sociales y sitios de compra on line, el director (s) del ISP indica que esta comercialización es “irresponsable”. “Estos kit o test no son autotest. Son test de uso controlado en estudios e investigaciones. Su venta para uso particular no es adecuada y menos aún sin adecuada supervisión ni control de un profesional de la salud que pueda interpretar el resultado y que pueda orientar los pasos a seguir”, advierte.
Hoy son 179 test que se encuentran oficialmente informados por las autoridades reguladoras de alta vigilancia sanitaria en dispositivos médicos del mundo y es la lista que publica el ISP.
Este listado es referencial y se publica para verificar los test reportados por las Autoridades Reguladores de Alta Vigilancia sanitaria de Dispositivos Médicos.
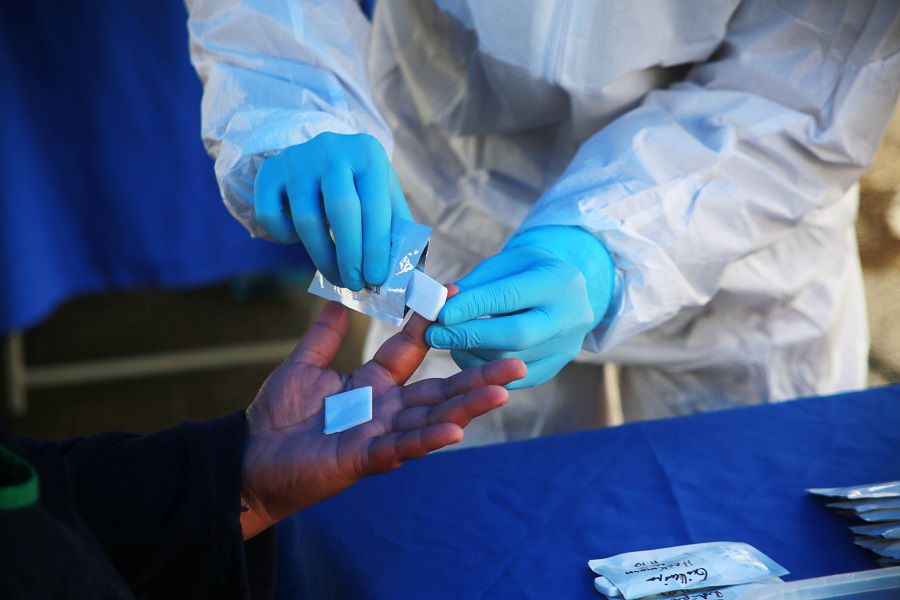
Según explica García, las empresas que importan a Chile estos productos, deben solicitar al ISP el Certificado de Destinación Aduanera (CDA), de acuerdo a lo dispuesto por la Ley N° 18.164, previo a su importación y comercialización en el territorio nacional, declarando la información que se le solicita, teniendo en cuenta que la calidad, seguridad y desempeño de estos productos es de responsabilidad de las empresas que los fabrican, importan, distribuyen y comercializan en Chile.
Reunión virtual con importadores de test rápidos
El Departamento de Dispositivos Médicos del ISP realizó una investigación, por medio de los Certificados de Destinación Aduanera (CDA), para identificar a los importadores de test rápidos, quienes voluntariamente accedieron a reuniones virtuales con profesionales del ISP, para informar sobre el correcto uso de estos dispositivos médicos y llevar un proceso de seguimiento.
La jefa del Departamento de Dispositivos Médicos del ISP, Janepsy Díaz señaló que “actualmente la Organización Mundial de la Salud (OMS), recomienda la implementación del protocolo de detección molecular para detectar Sars- CoV-2, a través de PCR en tiempo real. Este es el único método de diagnóstico validado, mientras se advierte una serie de limitaciones del uso de test de detección de anticuerpos IgM e IgG, debido a que no son considerados como método para la confirmación o diagnóstico de casos de Covid-19″.
Los test rápidos para el diagnóstico del virus Sars-CoV-2 corresponden a dispositivos médicos de diagnóstico in vitro Clase D, es decir de mayor riesgo, que actualmente no se encuentran sometidos a verificación de conformidad ni a exigencia de registro sanitario; según art.111 del Código Sanitario y DS 825/98 de dispositivos médicos. No obstante, son controlados y vigilados a través de la red de tecnovigilancia.

La regulación actual, permite al ISP informar el listado de kit de anticuerpos IgG e IgM que se encuentran reportados en los sitios web oficiales de las autoridades reguladoras de alta vigilancia sanitaria en dispositivos médicos (como son algunas de las agencias que forman parte del Foro Internacional de Reguladores de Dispositivos Médicos (IMDRF, por sus siglas en inglés), como la FDA de Estados Unidos, TGA de Australia, HSA de Singapur, ANVISA de Brasil, HEALTH CANADA de Canadá, PMDA de Japón y MFDS de Corea del Sur).
Empresas que usan test rápidos
El gerente general de Esachs (filial de la Asociación Chilena de Seguridad, ACHS), Nicolás Díaz, señala que el test rápido, como testeo por sí solo no sirve, pero sí puede ayudar cuando se realiza dentro de una estrategia realizada por las empresas, porque tiene que ir de la mano de modelos de contención. “Si se enmarca dentro de una estrategia de testeo seriado (con muestras periódicas), acompañado de medidas preventivas, puede ser una alternativa de monitoreo, pero en ningún caso reemplaza el gold estándar de diagnóstico que es el PCR”, dice.
En empresas con estrategia, la recomendación frente a un test rápido positivo, es la realización de un test PCR y si es positivo, idealmente, aislar a esa persona hasta tener el resultado PCR, explica Díaz. “Como no es test diagnóstico y, suponiendo que la persona no tiene síntomas, no es reconocido como sospechoso, sin embargo, lo recomendable es aislar y tomar PCR”.
Desde que se inició la pandemia, el actuar de las empresas ha ido cambiando, reconoce Díaz. “Hemos ayudado a empresas que han hecho distinto tipo de metodología. Algunas han realizado testeos masivos de PCR a sus trabajadores, otras han hecho test rápido, luego test de antígenos y ahora PCR. Van tomando distintas alternativas y además, van migrando”, explica Díaz
El director (S) del ISP señala que su aplicación a trabajadores puede ser válida en la medida en que exista una adecuada supervisión de profesionales de la salud, que conocen e interpretan los resultados de manera adecuada. “Podría ser útil como una pesquisa para saber a quienes debes realizar la PCR, que es la única técnica validada por la OMS y OPS para diagnosticar la presencia en tiempo real del virus. El test rápido, no determina la presencia del virus, determina presencia de anticuerpos”, insiste.
Más dudas que certezas
Para Jeannette Dabanch, infectóloga del Hospital Clínico de la Universidad de Chile, este tipo de test, causan “más dudas que certezas”. ¿La razón? La serología hasta ahora nunca ha sido muy buena para los virus respiratorios. “Hay una tremenda variabilidad de test tanto rápidos como cuantitativos o semicuantitativos. Muchos de ellos, si no la mayoría, no especifica los antígenos específicos seleccionados. La mayor parte de estos en Chile, tampoco han sido evaluados en su desempeño. Nos falta definir qué es lo que queremos responder con la serologia, cómo la vamos a interpretar y qué decisiones vamos a implementar con los resultados”.
En junio de este año, Chris Hyde, académico de salud pública y miembro del Comité Asesor de Diagnóstico del Instituto Nacional de Salud y Excelencia Clínica del Reino Unido (Nice) publicó un artículo de opinión en el blog de The British Medical Journal. En él, plantea que ante las pruebas serológicas o de anticuerpos que se están implementando se requiere mucho cuidado al juzgar la solidez de ellas, particularmente cuando se basa en estimaciones de precisión. “Los investigadores y los responsables de la toma de decisiones deben: ser precisos acerca de lo que están hablando cuando intercambian estimaciones de sensibilidad y especificidad, en particular la naturaleza del estándar de referencia y el momento en que se realizaron las pruebas en relación con el momento en que es probable que haya ocurrido la infección”. También plantea, que los investigadores estén abiertos a la posibilidad de que otros estudios distintos de los que miden la precisión puedan ser más útiles para comprender el valor de las pruebas serológicas.
Mónica Lafourcade, médico microbiólogo y ex presidente de la Sociedad Chilena de Infectología (Sochinf), explica que este tipo de test no está diseñado para el diagnóstico de una enfermedad actual. “Son rápidos y fácil de hacer pero los resultados no son tan buenos como la tecnología que se hace con equipos que leen anticuerpos y entregan un índice, un punto de corte con número que indican que hasta cierto número es negativo y sobre él, positivo”.
La especialista dice que los anticuerpos demoran en aparecer y lo hacen en la segunda semana después de inicio de síntomas cuando estos están presentes. “Puede servir para saber si una persona que tuvo síntomas y no fue al doctor tuvo o no Covid-19, para saber si una persona es candidata o no a una donación de plasma hiperinmune antes de evaluar sus anticuerpos, pero la sensibilidad que tienen es del 80%, en los test que son de calidad, lo que sigue siendo bajo porque los test instrumentales tienen una sensibilidad superior al 95%, entonces es una tecnología mediocre”.
A juicio de esta especialista, estos test deben ir acompañado de un análisis clínico (de los síntomas de la persona) y epidemiológico (analizar si estuvo o no en contacto con personas contagiadas, estudiar su círculo).
“Quiénes hacen estos exámenes tienen que saber qué hacer si la inmunoglobulina G (igG) sale positiva. O sale positiva la igM o ambas. Qué significan esos resultados. Además, tienen muchos falsos positivos”, insiste Lafourcade.
Ya en junio de este año, la Sochinf emitió una declaración señalando que los test serológicos son complementarios a la PCR y detectan dos tipos de anticuerpos: inmunoglobulinas M y G (IgM e IgG), que pueden detectarse entre 1 a 3 semanas después del inicio de síntomas. En general, la presencia de IgM indica una infección más aguda o precoz, y la IgG indica una infección pasada (memoria inmunológica), ya en recuperación.
¿Cuándo es útil la serología para SARS-CoV-2 o COVID-19? Según la Sochinf, sirve para pacientes sospechosos de infección por Sars-CoV-2 con estudio inicial de PCR para Covid-19 negativa (Se recomienda solicitar la serología desde los 7 a 14 días desde el inicio de los síntomas). También sirve para personas que han sido contactos estrechos de un paciente Covid-19 positivo y que han evolucionado asintomáticos. En estudios de seroprevalencia en población específica, como funcionarios de la salud que desean saber si desarrollaron inmunidad por contacto con SARS-CoV-2 de manera asintomática y en estudios epidemiológicos en determinadas poblaciones o comunidades, como evaluación de la respuesta a pruebas de vacunas y en la evaluación de potenciales donantes de plasma convaleciente de pacientes Covid-19.










Comenta
Por favor, inicia sesión en La Tercera para acceder a los comentarios.