Así será el ensayo de la vacuna más prometedora contra el Covid-19 que se realizará en Chile
Prototipo de la U. de Oxford y AstraZeneca será probada en cuatro centros, liderados por la Universidad de Chile. En total se enrolarán a más de tres mil voluntarios sin límite de edad e incluso con patologías previas como hipertensión, diabetes y asma.
AZD1222. Así se llama la tercera vacuna que ya está lista para ser probada en el país, una propuesta de la sociedad entre la Universidad de Oxford y la farmacéutica AstraZeneca que estuvo en pausa y que en las próximas tres semanas iniciará el enrolamiento de unos tres mil voluntarios para las pruebas en Fase 3.
Esta vacuna es una de las más esperadas por los especialistas ya que ha demostrado ser capaz de generan anticuerpos incluso en personas de tercera edad que la han probado y pronto será iniciado por la Facultad de Medicina de la U. de Chile.
Se trata de una vacuna que utiliza una versión debilitada de un adenovirus causante del resfrío común pero que ha sido diseñado para codificar la proteína del nuevo coronavirus para invadir las células (proteína Spike o S). El adenovirus común, actúa como un vehículo que transporta parte de la proteína, es reconocido por el sistema inmune pero en lugar de generar anticuerpos contra él, lo hace contra la proteína del coronavirus. Así, genera inmunidad frente a un posible contacto posterior con el virus.
Con ella, se completa el trío de vacunas que se probarán en el país: la vacuna de Janssen (Johnson & Johnson que ya inició la inoculación en voluntarios del Maule y este viernes inicia el enrolamiento de voluntarios por parte de los investigadores de la U. de Chile y la vacuna china del laboratorio Sinovac, un ensayo liderado por la Universidad Católica, cuyas dosis arribarán al país la próxima semana.
María Elena Santolaya, infectóloga pediatra del Hospital Luis Calvo Mackenna y profesora titular de la Facultad de Medicina de la U. de Chile, señala en las próximas tres semanas ya debieran comenzar a enrolar la los voluntarios e iniciar el proceso de importación de las dosis.
Características del estudio de la vacuna más prometedora
Este ensayo fase tres es diferente en varios aspectos a los otros dos estudios clínicos que se realizan en el país. “Este estudio pretende enrolar a tres mil personas mayores de 18 años pero sin límite de edad superior, pudiendo incorporar a adultos mayores. Además, también podrán participar personas que tengan alguna enfermedad crónica como hipertensión, diabetes, sobrepeso e incluso asma siempre que esté bajo control”, adelanta la especialista.
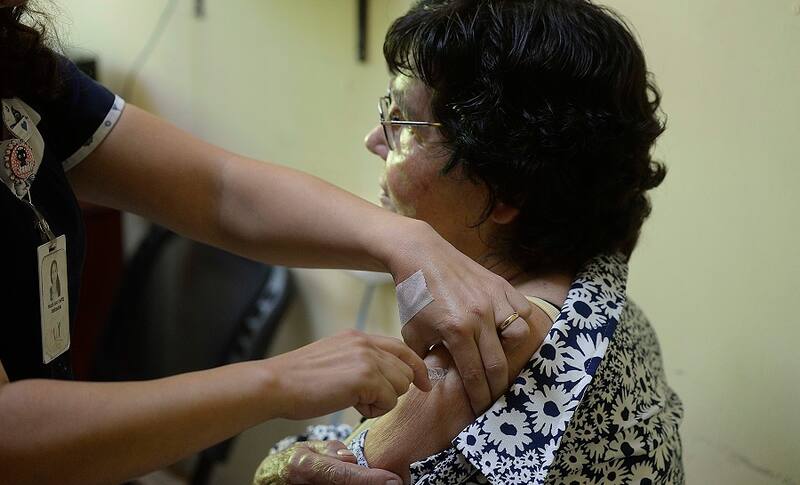
En total, cuatro centros los que serán parte del estudio fase 3 de esta vacuna: el Campus Norte de la Facultad de Medicina de la U. de Chile, la Clínica Las Condes, un centro en Quillota y el Hospital Luis Calvo Mackenna.
Otra particularidad de esta estudio es el número de personas que recibirán la vacuna. Lo habitual, es que en este tipo de ensayos la mitad de los voluntarios reciban la vacuna y la otra mitad, placebo. En esta oportunidad, dos tercios de los voluntarios recibirán dosis de vacunas y solo un tercio el placebo. “Esto es muy bueno, porque más personas pueden acceder a la vacuna”.
Además, adelanta Santolaya, las pruebas no serán exclusivamente en el personal de salud, por lo que también podrán participar voluntarios que se desempeñen en otras actividades. “Es un estudio abierto. Hoy día, todas las personas que realizan labores esenciales, quienes deben atender público, los que utilizan el transporte público, también tienen alto riesgo de contagiarse”, dice.
De todas las vacunas que están en estudios fase 3, la infectóloga reconoce que ésta es “muy promisoria” de acuerdo a los resultados obtenidos en los estudios previos. “Se está probando en 30 mil personas en el mundo. Es un estudio muy bien diseñado. Para mí es un orgullo participar, dirigir y proteger a un porcentaje de la población. De no mediar una buena vacuna, no tenemos otra forma de lidiar con este virus”, indica.
Hasta el momento se sabe que la vacuna, tras su inoculación produce dolor y sensibilidad temporal en el lugar de la inyección, dolor de cabeza leve a moderado, fatiga, escalofríos, fiebre, malestar y dolor muscular, reacciones que desaparecieron tras el uso de paracetamol profiláctico, un analgésico, y ocurrieron con menos frecuencia después de una segunda dosis.
El infectólogo de Clínica Las Condes, Ricardo Espinoza, señala que esta vacuna es la que tiene más voluntarios inoculados y la que más tiempo de desarrollo tiene. “Desde 1994 que están investigando esta vacuna de adenovirus de chimpancé modificado. Por lo mismo creo, personalmente, que es una de las mejores vacunas que se están desarrollando contra Covid-19”. Este centro es uno de los cuatro que participará en el ensayo de Oxford y Astrazeneca, obtuvo la autorización de su comité a fines de agosto y está a la espera de la aprobación del ISP.
La pausa
A comienzos de septiembre se supo de un grave efecto adverso en una de las personas voluntarias, hecho por el que se decidió pausar el estudio en todo el mundo. En un comunicado, la empresa confirmó que “como parte de los ensayos clínicos controlados y aleatorizados en curso de la vacuna contra el coronavirus, se ha activado un proceso de revisión estándar que ha llevado a la pausa voluntaria de la vacunación en todos los ensayos para permitir que un comité independiente revise los datos de seguridad de un único ensayo, evento de una enfermedad inexplicable que ocurrió en el ensayo de fase 3 del Reino Unido".
Una vez estudiado el caso, un comité externo decidió que era posible reiniciar la investigación.

Todo esto ocurrió mientras el Comité de Ética de la Universidad de Chile realizaba el análisis para la autorización del estudio, razón por la que ésta demoró un poco más. Hoy, el estudio que lidera la doctora Santolaya en el Hospital Luis Calvo Mackenna ya tiene permiso, por lo que solo falta ahora el visto bueno del Instituto de Salud Pública (ISP).
“Los comités de ética tienen la obligación de hacer un análisis muy detallado. Tiempo razonable es que se demoren dos meses. Las pausas también son importantes en estos estudios clínico. Tiene que existir una vigilancia de los efectos adversos o cualquier cosa que ocurra con los voluntarios. El comité de la universidad revisó todos estos antecedentes, los enviados por el comité externo que analizó lo ocurrido y se autorizó”, resume Santolaya.
COMENTARIOS
Para comentar este artículo debes ser suscriptor.
Lo Último
Lo más leído
1.
2.
3.
4.


















