Parches curitas, implantes mamarios o marcapasos: los dispositivos de salud sin sello de calidad
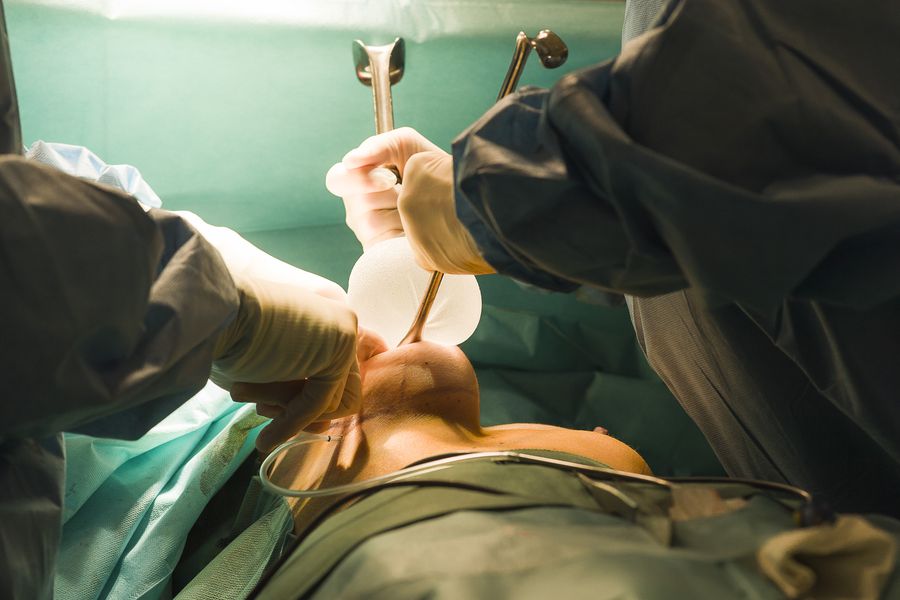
El gobierno propuso al Congreso legislar para asegurar un estándar mínimo en esta materia, pero desde la industria están en pie de guerra y argumentan que "los dispositivos médicos no son fármacos". El debate recién comienza.
Parches curitas, implantes mamarios, pasando por los marcapasos y sillas de ruedas. Así de amplio es el espectro de los dispositivos médicos que se utilizan en Chile y de los cuales sólo cinco tipos están regulados: preservativos, guantes de látex y quirúrgicos, además de agujas y jeringas hipodérmicas. El resto, unos dos millones de elementos, no están regulados y no tienen registro ante el Instituto de Salud Pública (ISP), por lo que se desconoce su calidad y si cumple o no estándares internacionales.
No son pocas las mujeres que han debido entrar a pabellón, de urgencia, para remover sus implantes mamarios, tras sufrir una inexplicable rotura, con numerosos riesgos de salud asociados. El último caso conocido lo protagonizó la ex chica reality y hoy esposa del futbolista Mauricio Isla, la española Gala Caldirola, quien debió suspender la lactancia de su bebé, luego de que uno de sus implantes se rompiera.
¿Por qué no hay regulación en este tema? Según Stephan Jarpa, ex director de ISP y actual director de la agencia Regulatoria InHouse, explicó que desde 2010 se ha intentado aumentar los controles, sin embargo, "queda en nada porque no hay prioridades políticas y financieras, que finalmente terminan por bajar dichos intentos", dijo.
Agregó que "esto es un fracaso frente a países vecinos que tienen decenas de dispositivos médicos registrables y regulados". Es el caso de Brasil, se vigila la calidad de más de mil productos, mientras que la FDA (Food and Drug Administration) de Estados Unidos, ha registrado más de 190.000 dispositivos médicos.
Esta falta de fiscalización implica un constante amenaza para los pacientes y así lo admiten los expertos: "Hoy no sabemos qué se usa, de dónde viene y si cumplen garantías de calidad. Es el paraíso para el mercado barato y malo. Asimismo, los riesgos que puede significar para un paciente y su derecho a dispositivos de calidad", agregó Jarpa.
Coincidiendo en este diagnóstico, gobierno está impulsando una articulado para vigilar la calidad de los dispositivos médicos, como parte de la Ley de Fármacos II que se discute en la Comisión de Salud de la Cámara de Diputados. Pero el panorama se ve complejo: la regulación ha desatado una pugna entre los proveedores de salud, que se oponen a ser normados junto con los medicamentos. Y ya han iniciado una ofensiva, con insertos en la prensa donde plantean que el "sistema de salud está bajo amenaza" y emplazando al gobierno a que separe de dicha norma los dispositivos, pues se tratan, a su juicio, de elementos "completamente disímiles en funcionalidad, complejidad tecnológica y certificación".
Al respecto, el director ejecutivo de la Asociación de Proveedores de Industria de la Salud (Apis), Eduardo del Solar, indicó que los dispositivos no son fármacos y por ende deben normarse de forma distinta. "Queremos una regulación, porque consideramos que es bueno para la industria, pero esta debe ser acorde con la materia, debe cubrir toda la gama que existe de dispositivos que pueden ser in vitro, de acción mecánica, de acción eléctrica, extracorpóreos, son distintos a los medicamentos y por lo tanto deben tener una legislación distinta".
Desde el ISP, la jefa del Departamento de Dispositivos Médicos, Janepsy Díaz, opina distinto: "No hay ningún problema de que la regulación de dispositivos vaya dentro del marco legal de fármacos, ya que ahí sólo se acoge una parte, mientras que la regulación será independiente, con estándares internacionales y enfocada a dispositivos".
Justamente para ello, el ISP está trabajando junto al Banco Interamericano de Desarrollo (BID), para definir los mecanismos en que se implementará la normativa, que permitirá sellar la calidad de dispositivos y garantizar su calidad para los pacientes.


Comenta
Los comentarios en esta sección son exclusivos para suscriptores. Suscríbete aquí.